一、医疗器械监管机构
埃及注册和批准医疗器械和体外诊断器械由埃及药物监管局(Egyptian Drug Authority,EDA)以及药物政策和规划中心(Drug Policy and Planning Centre,DPPC)负责。三类器械由EDA负责注册,I类、IIa和IIb类器械由药物政策和规划中心负责注册。
注册官网:https://medevice.edaegypt.gov.eg/
Regulatory Guideline for Procedures of Registering Imported and Local Medical Devices holding International Quality Certificates
《埃及持有国际质量证书的进口和本地医疗器械注册程序法规指南》
Regulatory Rules of Registration and Market authorization of In Vitro Diagnostic Medical Devices
《体外诊断医疗器械注册和上市许可合规指南》
Regulatory Guideline of Issuance of Import Approvals of All Types Medical Devices
(《埃及各类医疗器械进口许可监管指南》)
The Egyptian Guideline for Medical Device Vigilance System
《埃及医疗器械警戒系统指南》
Guideline For Good Regulatory Oversight of Clinical Trials by Egyptian Drug Authority
《埃及药物监管局临床试验合规监督指南》
Guidance on Requirements for Unique Device Identification (UDI) for Medical Devices
《医疗器械唯一器械标识(UDI)要求指南》
Labeling requirements for medical devices, medical and laboratory equipment and in vitro Diagnostics, components and production inputs
《医疗器械、医学和实验室设备、体外诊断医疗器械、组件和生产输入的标签要求》
Egyptian Guidelines for Detecting & Reporting of Adverse Reactions for Pharmaceutical products and Medical Devices
《埃及检测&报告药品和医疗器械不良反应指南》
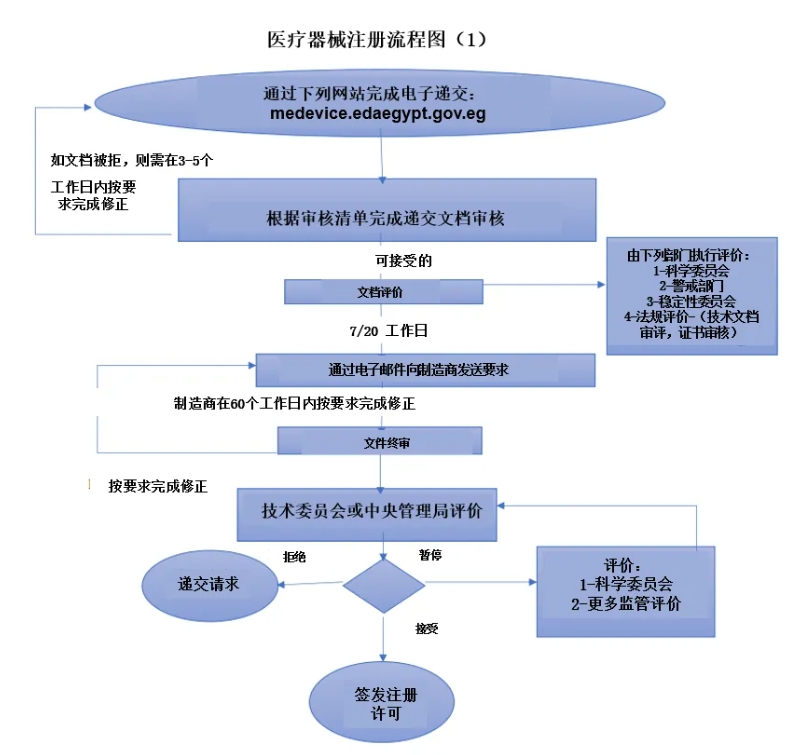
埃及医疗器械上市,必须提交注册文件。注册文件会分配临时代码,文件内容包括符合性声明,器械原产国自由销售证书,ISO 13485:2016证书和CE证书(该国监管部门强烈建议持有),以及由进口商提交给EDA的代表制造商和进口商的函件(声明器械符合EDA的警戒法规并报告任何召回、警告或现场安全纠正行动并告知器械在埃及发生的任何事故)等。 申请人:外国制造商必须授权一名当地授权代表(local authorized representative, ERH)负责器械在埃及的进口和上市后监管等活动。 时间框架和成本:审评技术文件可能持续30个工作日,且给制造商留有60个工作日用于其回复由EDA/DPPC提出的审评问题。 证书有效期:进口许可证的有效期医疗器械为10年,体外诊断医疗器械为5年。 文件语言和标签:医疗器械专业使用的标签(标签和使用说明书)可用英文书写,而国内使用器械则使用阿拉伯语。 EDA鼓励并促进已在欧洲上市(持有CE证书)和美国、加拿大、澳大利亚和日本等国家上市的器械进入埃及市场。 1.首次注册/再注册费用支付收据。 2.董事会主席批准的原委托书,其上附有负责医疗器械注册事务并接收注册证的人员签名。 3.一份遵守安全性操作规程的声明。(安全操作规程基于埃及药物警戒中心的总经理发布的公告且已获医疗器械中心管理局批准)。 4.对于制造商,其应符合下列要求: √一份委托埃及代理注册进口公司的法律信函,其中列明器械名称,包括器械的商品名。(该法律信函由合法制造商或由其代表具有合法法律关系的相关方签发)。 √该委托书或由制造商母公司或母公司委托具有合法法律关系的一方签发(其中关系函件应提及母公司,合法制造商和负责签发注册委托函件的实体,并应列明它们的名称和地址)。 √埃及进口公司更新的商业记录和注册申请人的进口许可证 √制造商的名称和经销公司的名称应列于进口许可证上,还应附上制造商于其供应商的关系函件。(与国外供应商签订的合法经销或代理合同,合同有效且有固定期限) √国外制造商和外国经销商或供应商之间的关系函件(如有),应清晰陈明外国经销商或供应商签订合同和代表制造商进行国外代理的权利,且此关系必须合法。 5.对于科学办公室,应满足下列要求: √科技办公室执照 √关系(如有) √为非科技办公室母公司分支机构的制造商生产的医疗器械执行注册的科技办公室,应提交下列文件: -医疗器械合法制造商委托科技办公室从事埃及注册的法律函件 -科技办公室母公司出具的法律函件,声明其对器械制造商委托科技办公室从事埃及注册事宜无异议。 -董事会主席批准的原委托书,其上附有负责医疗器械注册事务并接收注册证的人员签名。 -一份遵守埃及药物警戒中心的安全性操作规程的声明。 6.所需证书应有效,且有效期从提交文件之日起不少于3个月: 1)自由销售证书 2)美国FDA颁发的CFG证书 3)CE证书 4)ISO13485:2016证书 5)符合性声明证书 医疗器械注册文档接收程序: 1.审评管理中心工作人员接待注册申请人代表,将医疗器械名称加入费用支付收据并指定相应审核部门(当地或进口)。 2.器械制造商应通过下列网站链接在电子注册平台完成申请: medevice.edaegypt.gov.eg 3.制造商自提交常规申请起的5个工作日和提交快速通道申请的3个工作日内通过该平台收到相应回复:接收、拒绝或暂停申请直至满足要求。 如果申请被接收,则申请会直接移交至审批专家和研究相关负责人,由审批专家和研究相关负责人报告和发送相关要求给制造商并要求其完成。 如果为申请暂停直至满足要求的情况:如果在(至多)90日工作日内容仍有文档未能达到公布文件清单的要求,则申请暂停;在此期限后,申请则被视为撤销。 当制造商满足了要求, 则申请通过平台完成,使用之前获得的申请编号。 如果申请被拒绝:如果制造商申请文档中有任何数据与支付收据或所要求的文档不匹配,或该申请不受该申请部门的管辖, 则申请会被拒绝。 医疗器械注册文档评定程序: 平台自收到常规申请的20个工作日内或快速通道申请的7个工作日内会完成文件审批和提出相关要求。 申请器械应符合医疗器械安全性程序: 进口医疗器械首次注册和再注册时应提交一份文件至医疗器械安全性部门。同时,制造商还应提供一份安全性声明,声明制造商有现成的医疗器械警戒系统并且声明其所有的活动都符合埃及警戒中心——医疗器械安全性部门的《医疗器械警戒系统指南》。 医疗器械制造商必须按照《医疗器械警戒系统指南》规定的时间框架向埃及警戒中心——医疗器械安全性部门报告其器械在全球的召回、现场安全性通知(FSN)、现场安全性纠正行动(FSCA)程序,或在埃及境内监测到的任何事故。 医疗器械注册文档完成申请程序: 完成的注册文件文档应通过medevice.edaegypt.gov.eg官网提交。制造商在该网站上传文件时应遵守以下规则: -文档必须为原件。 -文档必须盖有制造商的官方印章。 -文档必须由制造商法人代表签字。 -文档必须以扫描件形式上传官网或使用电子签名。 注:不符合上述要求的其它文档不予接收。 医疗器械注册完成签发注册证: 针对医疗器械完成所有注册申请文件的递交、费用支付和器械评审通过后,签发该医疗器械注册证,有效期10年。 医疗器械注册整体要求: 1.注册成为单一注册编号的医疗器械必须具有以下共同特征:商品名、GMDN或UMDN编码、分类、预期用途、制造商、原材料和年龄组(除尺寸不同外)。 缝线如果原材料不同,也不应单独注册,而是授予单一注册证。 如果医疗器械上述元素有所不同,则应注册为不同医疗器械,且各医疗器械会签发单一注册证并分配一个单一注册证编号。 2.如果医疗器械上述元素相同但在其他方面不同,则这些医疗器械应提交至专业科学委员会以研究其不同并决定是否这些差异构成实质性不同,进而将器械分开进行注册。 3.注册为一个系统的骨科医疗器械的要求: 应用于关节、螺钉和骨板。 制造商提供的原器械目录应附于注册文件后,从而确保计划注册为单一系统的部件与目录保持一致,且制造商应基于骨科疾病和骨外科专业科学委员会的决定提供证明,证实这些计划注册的部件为单一系统的部件。 提交注册的每一个器械应单独提交至骨科疾病和骨外科专业科学委员会。 提交注册的医疗器械应基于CE设计检验证书、或自由销售证书、或FDA证书被视为是一个系统,前提是每个系统的部件及其代码应清晰地显示于自由销售证书或FDA证书。 4.原注册证为其器械制造商所有,且任何其他代理人/经销商持有的复印件将不用于注册考虑。 5.不允许对注册证上的数据进行任何删减或变更,否则注册证将视为无效。 6.通过口腔、鼻腔或耳腔使用的医疗器械会在注册程序中进行器械分析。 7.医疗器械注册证书的有效期自注册之日后10年到期,且再注册初始受理申请应在注册证有效期最后一年前3个月提交。 8.除获得埃及药物监管局相关监管部门的书面许可外,不得在任何媒体介质上为医疗器械做广告。 9.医疗器械注册证基于该器械的质量证书签发。国外制造商和进口商为器械的有效性和技术安全性承担完全责任,任何因使用该器械导致的缺陷或危险为其责任。 10.应使用由制造商具有财务授权的代表签发的正式授权书提交注册部门。 11.不得对医疗器械进行任何变更,除非医疗器械中央管理局基于变更类型适用程序进行批准,否则注册证将撤销。 12.应用医疗器械召回制度。 13.制造商必须实施安全性要求。 体外诊断医疗器械注册申请程序 A.评价申请并注册体外诊断医疗器械 ·如果为已获得国际质量证书的进口体外诊断医疗器械,应适用以下程序: -进口的体外诊断医疗器械应在器械原产国或某个已获批准的参考国上市销售; -体外诊断医疗器械的注册申请应根据体外诊断医疗器械注册申请表提交。 -申请人应根据体外诊断医疗器械注册文档审核清单提交注册文档。 -文档应首先由接收部门检查。如果文档达到基本文档要求,其应移交至研究和评价部门,该评价部门将在接收文档之日起的20个工作日内完成器械评价。 -如果注册文档有待继续完善的要求,申请人将获得及时通知以便在最大60个工作日内完成全部注册文档要求。如果在此期限内未能满足全部注册要求,申请人可递交申请延期30天。如果在此期限内仍未能满足所有注册要求,注册申请将视为不成功。 -注册申请人如果达到全部注册文件要求,则注册文件将在自申请递交日之后10个工作日内完成评估。之后的5个工作日将签发技术文档报告。 体外诊断医疗器械注册通用要求 申请人应有义务完成下列内容: -在器械外包装上印有工厂名称、地址、有效期、批号和注册号。如果为进口的体外诊断医疗器械,则还需印有合法制造商名称、原产国、有效期、批号和注册号。 -除非医疗器械中央管理局根据变更类型适用程序签发许可,勿要进行体外诊断医疗器械的任何变更。否则,上市许可将被视为无效。 -应用医疗器械召回制度。 -递交进口体外诊断医疗器械文档以获得进口审批。 -之前尚未上市销售的医疗器械,可获准上市销售6个月而无需上市许可,前提是申请人应在6个月到期前申请获得上市许可,该6个月起始日期为进口器械首个进口许可获签发之日。