

巴基斯坦药品监管局(Drug Regulatory Authority of Pakistan,简称DRAP)的监管职能包括注册和上市许可、警戒、市场监管、机构许可、监督检查、实验室检测、临床试验监管、药物警戒和生物制品批签发等。
医疗器械委员会(Medical Device Board,简称MDB)负责医疗器械登记或注册、经营许可、医疗器械进出口许可证发放及相关事项。
Medical Devices Rules, 2017
《2017年医疗器械法规》
Notification of Amendment in the Medical Devices Rules 2017
《2017年医疗器械法规修订通知》
→从DRAP获得医疗器械生产或进口的经营许可证(Establishment License)
→从MDB认可的合格评定机构(CAB)获得合格评定证书,评估内容涉及医疗器械质量管理体系、上市后监督系统和技术文件
→向MDB申请医疗器械注册,提交所需的文件并缴纳费用,其中
A类医疗器械应进行登记(enlistment)
B类,C类,D类医疗器械应进行注册(registration)
对于进口的医疗器械,需要找到授权代理(authorized representative,AR)负责提交注册申请。完成注册事宜,负责与MDB沟通其处理有关医疗器械的任何监管事宜。
→对申请进行评估,并对生产设施或进口设施进行审查后,MDB发放注册证书
→从DRAP获得医疗器械的进口/出口许可证
①确定产品分类
Medical Devices Rules, 2017
(《2017年医疗器械法规》附表A)
医疗器械分为四类:A类、B类、C类和D类。A类风险最低,D类风险最高。
分类依据:按照风险等级进行分类。根据医疗器械产品对患者或用户造成伤害的可能性大小(即所带来的危害),进而根据其预期用途和所用技术,确定产品分类。

②产品分组
Medical Devices Rules, 2017
(《2017年医疗器械法规》附表B)
(1)Single 单品
(2)Family系列
(3)System 系统
(4)Set 套装
(5)in-vitro test kit IVD测试套件
(6)in-vitro cluster体外诊断产品集群
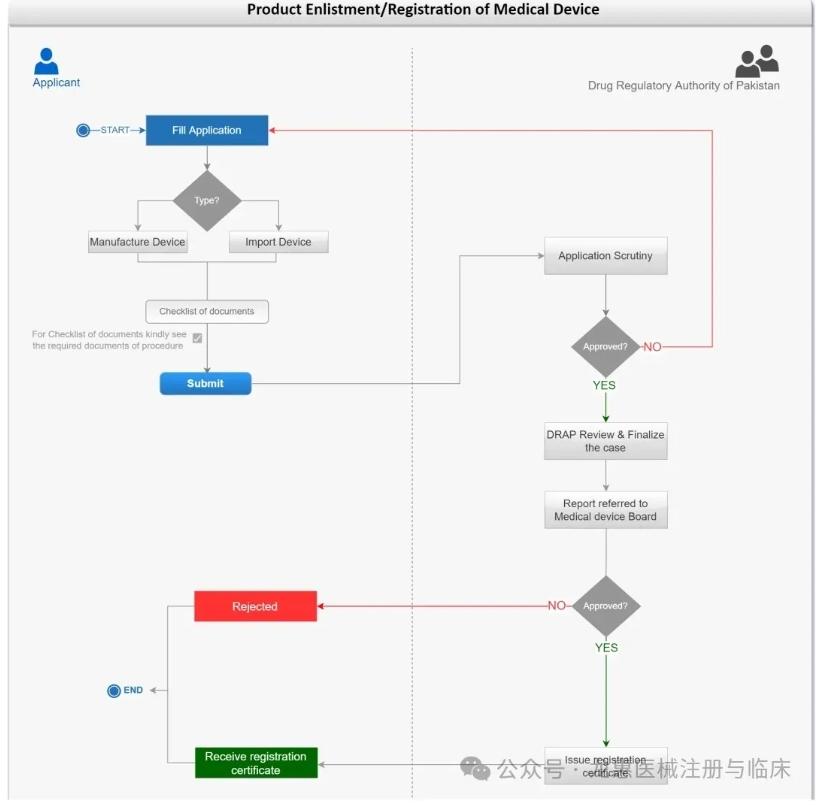
③注册流程和材料准备
注册流程
→根据产品登记/注册类型填写申请
进口医疗器械,A类产品填写表格-6A((FORM-6A), B类、C类和D类产品请填写表格-7A (FORM-7A )
→附上所需文件并提交给DRAP
→如申请不符合要求,DRAP退回申请并附上意见
如申请符合要求,DRAP对申请和文件进行评估
→DRAP启动现场审查并准备报告
→DRAP进行审核,最终确定批准登记/注册的医疗器械产品
→如申请未通过,DRAP将告知申请人其申请被拒
如申请通过。DRAP将颁发产品登记/注册证。
申请材料
进口医疗器械产品的登记或注册,应按照下列表格中的要求向MDB提出申请:|
(1)A类医疗器械:
FORM-6A APPLICATION FORM FOR ENLISTMENT OR RENEWAL OF CLASS A MEDICAL DEVICE OR ACCESSORY OR COMPONENT FOR IMPORT
CHECKLIST FOR ENLISTMENT OR RENEWAL OF CLASS-A MEDICAL DEVICE OR ACCESSORY OR COMPONENT FOR IMPORT
√申请表:“FORM-6A”
√进口商详细信息
√制造商详细信息
√产品详细信息,包括经原产国正式公证的制造商/上市许可持有人的代理协议/授权书原件;由巴基斯坦大使馆证明的原产国自由销售证书;由巴基斯坦大使馆证明的参考国有效自由销售证书原件(《2017年医疗器械法规》,第67条);经原产国正式公证的质量管理体系证书(ISO 13485)/ GMP证书:经原产国正式公证的完整QA 证书或其他具有同等效力的证书;安全和性能基本原则;符合性声明(DoC)等
√技术文件,包括完整的产品说明、关键功能元件、功能性配方和组成;适应症(诊断、治疗、预防、治愈/缓解);创新结构说明;禁忌症和警告;详细的生产和质量控制流程;标签样本、宣传手册和包装等。
√声明 (见“FORM-6A” DECLARATION部分)
√费用保证金证明
√MDB要求提供的其他文件
*需提供USB/CD电子版
(2)B类、C类和D类医疗器械:
FORM-7A APPLICATION FORM FOR REGISTRATION OR RENEWAL OF CLASS B, C& D MEDICAL DEVICE OR ACCESSORY OR COMPONENT FOR IMPORT
CHECKLIST FOR REGISTRATION OR RENEWAL OF CLASS B, C & D MEDICAL DEVICE OR ACCESSORY OR COMPONENT FOR IMPORT.
√申请表:“FORM-7A”
√进口商详细信息
√制造商详细信息
√产品详细信息,包括经原产国正式公证的制造商/上市许可持有人的代理协议/授权书原件;由巴基斯坦大使馆证明的原产国自由销售证书;由巴基斯坦大使馆证明的参考国有效自由销售证书原件(《2017年医疗器械法规》,第67条);经原产国正式公证的质量管理体系证书(ISO 13485)/ GMP证书:经原产国正式公证的完整QA 证书或其他具有同等效力的证书;安全和性能基本原则;符合性声明(DoC);标签样本、宣传手册和包装等
√费用保证金证明
未经参考国批准或不允许在参考国自由销售的医疗器械(见《2017年医疗器械法规》,第67条所述参考国部分),需提供以下:
√技术文件,包括对创新特征的说明(如有),禁忌症和告知使用医疗器械的特定风险或危害的警告;使用说明书(IFU), 具有无菌或测量功能的医疗器械的验证信息等
√软件验证研究文件(有源医疗器械),该文件应包括最终发布前进行的所有验证、确认和测试的结果
√安装和维护说明
√含有生物材料的医疗器械(如适用),需提供:
医疗器械和医疗器械制造过程中使用的所有动物、人类、微生物或重组来源的材料清单,来源选择或供方详细信息;
√提供关于组织、细胞和物质的收获、加工、保存、测试和处理的详细信息;
√记录保存系统流程的完整描述
√报告或证书,包含对所用材料进行生物相容性测试的目标、方法、结果、讨论和结论等信息。
√报告或证明,其中包含对医疗器械进行临床前物理测试的目的、方法、结果、讨论和结论等信息。
√具有无菌或测量功能的医疗器械的验证信息(如适用):
√声明 (见“FORM-7A” DECLARATION部分)
√MDB要求提供的其他文件
*需提供USB/CD电子版
④注册费用和审核周期
(1)注册费用

(2)审核周期
DRAP注册的整个周期可能需要数月到一年甚至更长时间。
