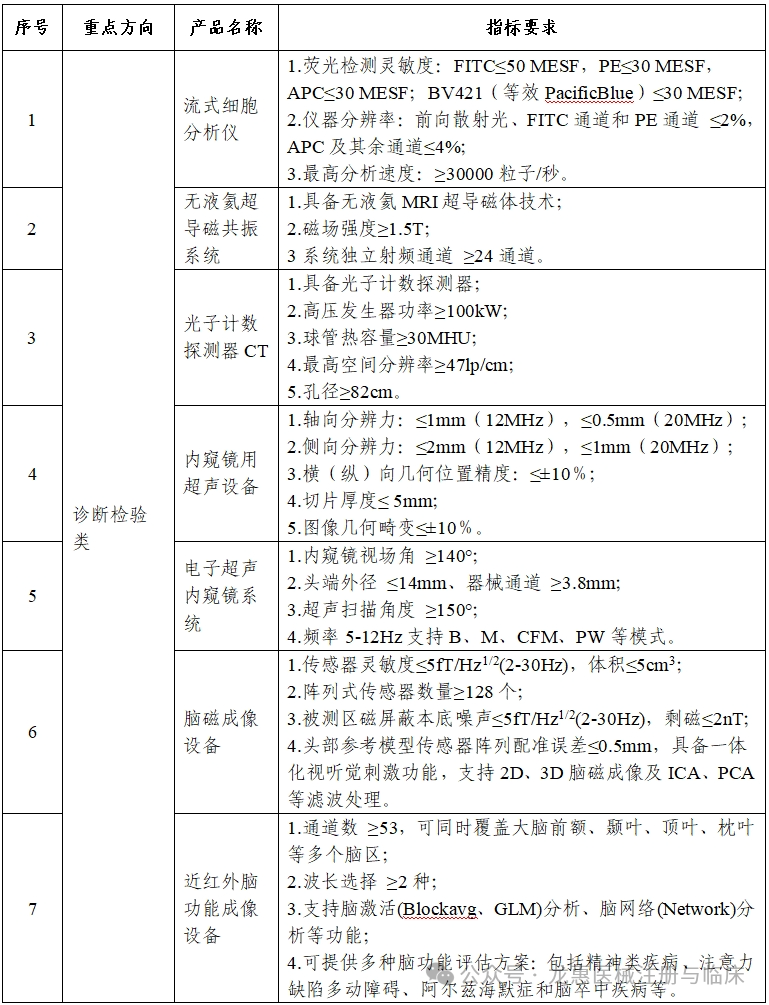
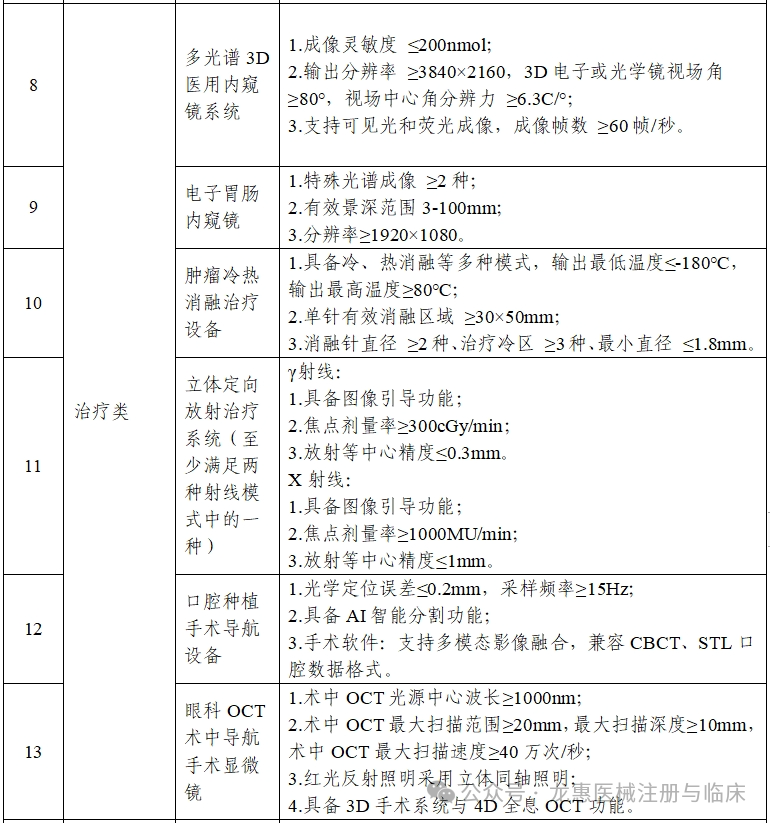
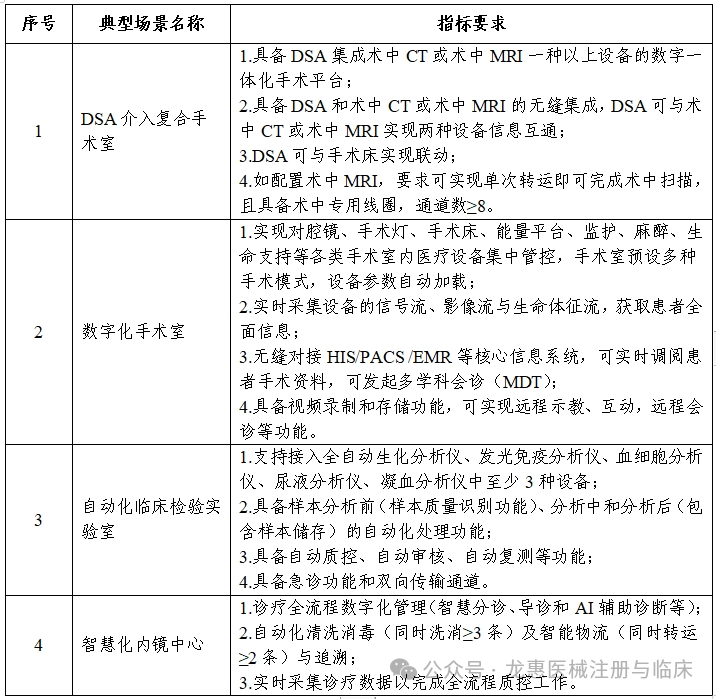
工业和信息化部、国家卫生健康委、国家药监局等三部门近日印发通知,组织开展2025年高端医疗装备推广应用项目申报工作。本次推广应用项目重点面向高端医疗装备重点产品和典型场景,遴选一批技术创新水平与临床应用水平处于全国前列,对医工协同创新、中试验证、临床研究、迭代升级与推广应用等具有较强引领带动作用的项目。本年度重点开展5类重点产品和4类典型场景的推广应用。
各省、自治区、直辖市及计划单列市、新疆生产建设兵团工业和信息化、卫生健康、药品监督主管部门:为深入贯彻健康中国、制造强国战略部署,加快推进高端医疗装备创新发展,开展新技术新产品新场景大规模应用,现就2025年度高端医疗装备推广应用项目申报工作有关事项通知如下:面向高端医疗装备重点产品和典型场景,遴选一批技术创新水平与临床应用水平处于全国前列,对医工协同创新、中试验证、临床研究、迭代升级与推广应用等具有较强引领带动作用的项目。本年度重点开展5类重点产品(见附件1)和4类典型场景(见附件2)的推广应用。原则上申报主体为牵头医疗装备生产企业、牵头医疗机构和参与生产企业或医疗机构组成的医工联合体,联合体内所有单位数量原则上不超过15个。医工联合体内所有单位须为在中华人民共和国境内注册,具有独立法人资格的企事业单位,近三年未发生重大安全、环保、质量或医疗事故等,没有司法、行政机关认定的违法失信行为或涉嫌违法正在接受审查等情况。牵头单位拥有较强的行业引领地位。每个单位最多牵头或参与申报3个推广应用项目。同一单位在同一类别项目申报中,参加2个及以上联合体的相关申报均视为无效。重点产品类项目所申报的产品,牵头医疗装备生产企业须已取得中华人民共和国医疗器械注册证。典型场景类项目中应用的核心产品,须由联合体内单位取得中华人民共和国医疗器械注册证。申报材料及所附资质等应真实、合法,不得涉及国家秘密、商业秘密等内容。(一)产品使用要求
在推广应用过程中,高端医疗装备的使用应符合《医疗器械监督管理条例》《医疗器械生产监督管理办法》和《医疗器械临床使用管理办法》等有关要求。医工联合体应建立较为完善的医疗装备研制生产、临床研究管理和资金保障体系,医疗机构重点保障高端医疗装备临床应用研究及推广的技术和环境条件,医疗装备生产企业重点保障高端医疗装备运行安全及改进提升的技术和软硬件条件。四、工作程序
(一)组织申报
各地工业和信息化主管部门会同卫生健康、药品监督主管部门组织符合条件的单位,按照自愿原则组成医工联合体,编写申报材料(见附件3)。牵头单位对医工联合体内的参与单位资质和相关材料负责。牵头医疗装备生产企业所在地的工业和信息化主管部门、牵头医疗机构所在地的卫生健康主管部门分别对单位资质和项目申报材料进行审查,并分别填写材料审查表(见附件4)。牵头医疗装备生产企业所在地的工业和信息化主管部门于2025年11月3日前,将推荐汇总表(见附件5)、材料审查表(包括工业和信息化、卫生健康主管部门审核意见)、申报材料的纸质版和电子版一式三份报送工业和信息化部(装备工业一司)。工业和信息化部、国家卫生健康委、国家药监局组织专家或第三方机构对推广应用项目申报材料进行评审,遴选并公布符合要求的推广应用项目名单。推广应用项目实施周期一般不超过3年。附件:
工业和信息化部办公厅
联系
( 010 ) 63311696/97/98
顶部