
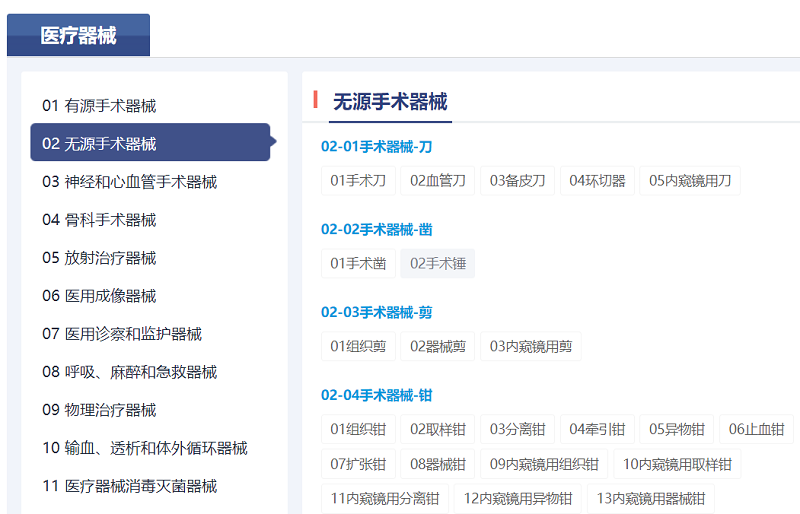
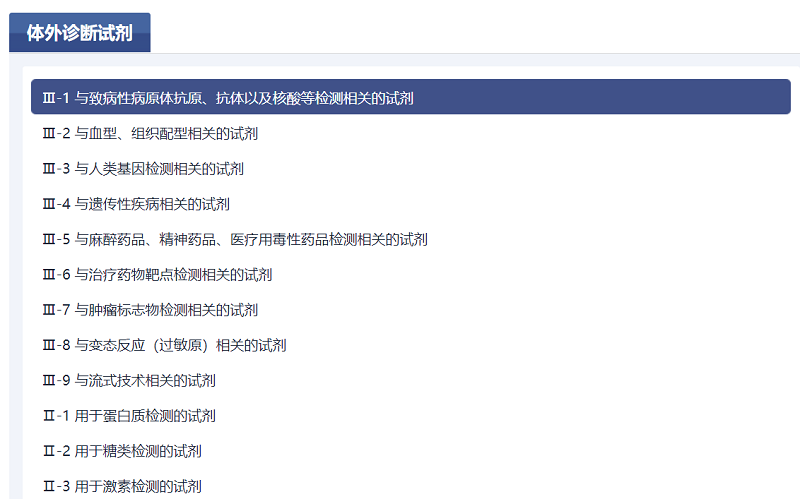
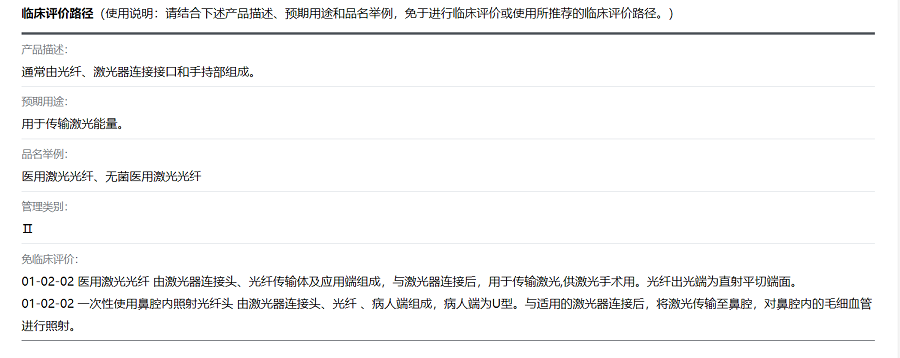
二是内容更丰富。医疗器械技术文件的内容在指导原则和相关标准的基础上增加了技术审评要点临床评价推荐路径。临床评价路径来自于器审中心发布的临床评价推荐路径的相关通告,请结合产品描述、预期用途和品名举例,查询所描述产品的临床评价推荐路径。
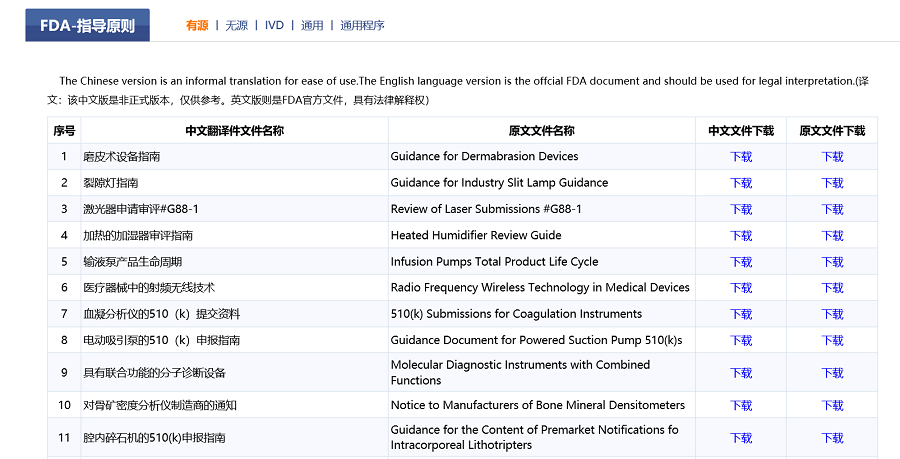
 三是类型更多样。除中国指导原则外,栏目新建FDA指导原则、欧盟指导原则板块,向公众提供中心组织翻译并校对的FDA、欧盟医疗器械指南。按照有源、无源、通用等进行分类,原文、中文一一对应,同步提供下载链接。
三是类型更多样。除中国指导原则外,栏目新建FDA指导原则、欧盟指导原则板块,向公众提供中心组织翻译并校对的FDA、欧盟医疗器械指南。按照有源、无源、通用等进行分类,原文、中文一一对应,同步提供下载链接。

五是阅读更便捷。为满足不同用户的使用需求,“指导原则”栏目同步建设适配手机阅读的界面,兼顾电脑端和手机端用户的阅览需求,方便公众在不同设备中进行文件查阅。

“指导原则”栏目将保持动态更新,持续优化,可点击
https://www.cmde.org.cn/flfg/zdyz/flmlbzh/flmlylqx/index.html进行体验。
声明:此文版权归原作者所有,文中图片均已获得版权方授权使用。若有来源错误或者侵犯您的合法权益,您可通过网站谈话框与我们取得联系,我们将及时进行处理。