
根据《医疗器械监督管理条例》(国务院令第650号)的规定,对中华人民共和国境内的医疗器械按照风险程度实行分类管理。共分3类,分别是第I类、第II类、第III类。
境内第三类体外诊断试剂风险程度低,具有较高风险,需要采取特别措施严格控制管理;实行注册管理,无论境内、境外医疗器械生产企业均需要在国家药监局进行注册。
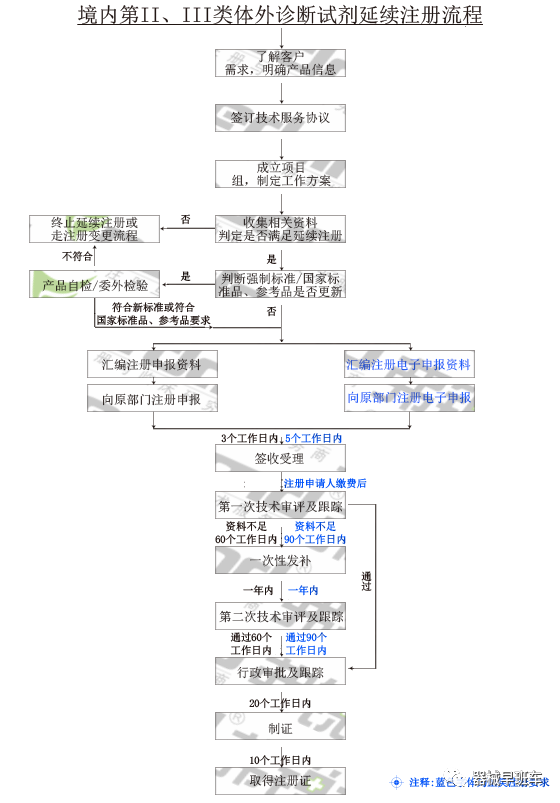
医疗器械注册证有效期届满需要延续注册的,注册人应当在医疗器械注册证有效期届满6个月前,向食品药品监督管理部门申请延续注册。
1、《医疗器械监督管理条例》(国务院令第650号)
2、《体外诊断试剂注册管理办法》(局令第5号)
3、《医疗器械分类规则》(局令第15号)
4、《医疗器械分类目录》(2018)
5、《医疗器械说明书和标签管理规定》(局令第6号)
6、《医疗器械临床试验质量管理规范》(局令第25号)
7、《医疗器械生产质量管理规范》(2014年 第64号)
8、《医疗器械生产监督管理办法》(局令第7号)
9、《医疗器械生产企业质量体系考核办法》(局令第22号)
10、《体外诊断试剂注册管理办法修正案》(局令第30号)
11、《关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告》(2014年第44号)
12、《总局关于执行医疗器械和体外诊断试剂注册管理办法有关问题的通知》( 食药监械管〔2015〕247号)
13、《总局办公厅关于体外诊断试剂说明书文字性变更有关问题的通知》(食药监办械管〔2016〕117号)
14、《国产第三类医疗器械延续注册审批服务指南》