国产第三类医疗器械注册核发、变更、延续主要依据《医疗器械监督管理条例》、《医疗器械注册与备案管理办法》、《体外诊断试剂注册与备案管理办法》等法规。
本文相关思维导图文件来源于广东器械审评,供大家参考,文末附高清电子版下载。
国产三类医疗器械首次注册•申报前准备工作
适用对象:医疗器械生产企业自主生产的三类医疗器械
法规依据:《医疗器械注册与备案管理办法》、《体外诊断试剂注册与备案管理办法》、《关于发布医疗器械注册电子申报目录文件夹结构的通告》

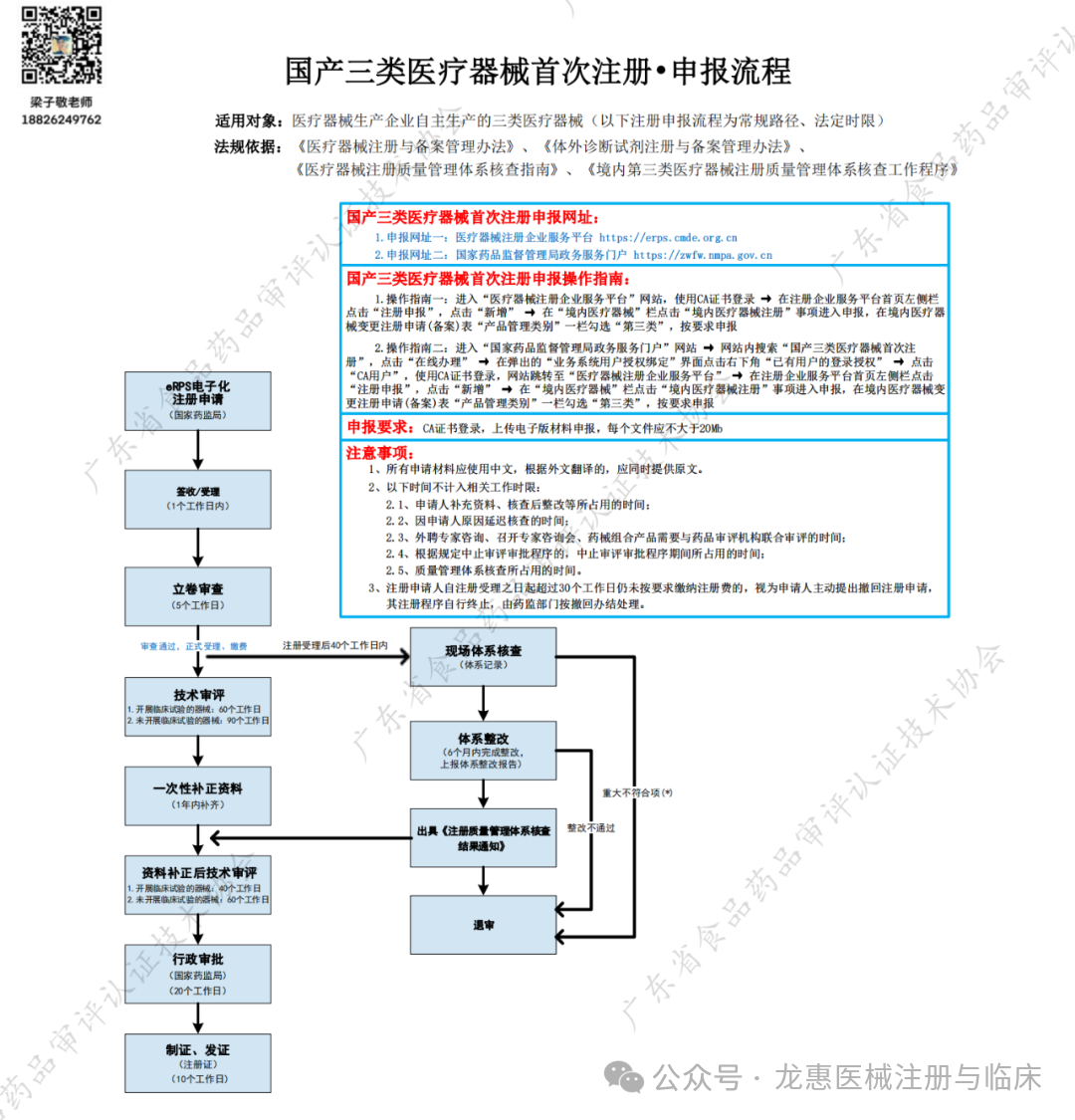
国产三类医疗器械首次注册•申报流程
适用对象:医疗器械生产企业自主生产的三类医疗器械(以下注册申报流程为常规路径、法定时限)
法规依据:《医疗器械注册与备案管理办法》、《体外诊断试剂注册与备案管理办法》、《医疗器械注册质量管理体系核查指南》、《境内第三类医疗器械注册质量管理体系核查工作程序》
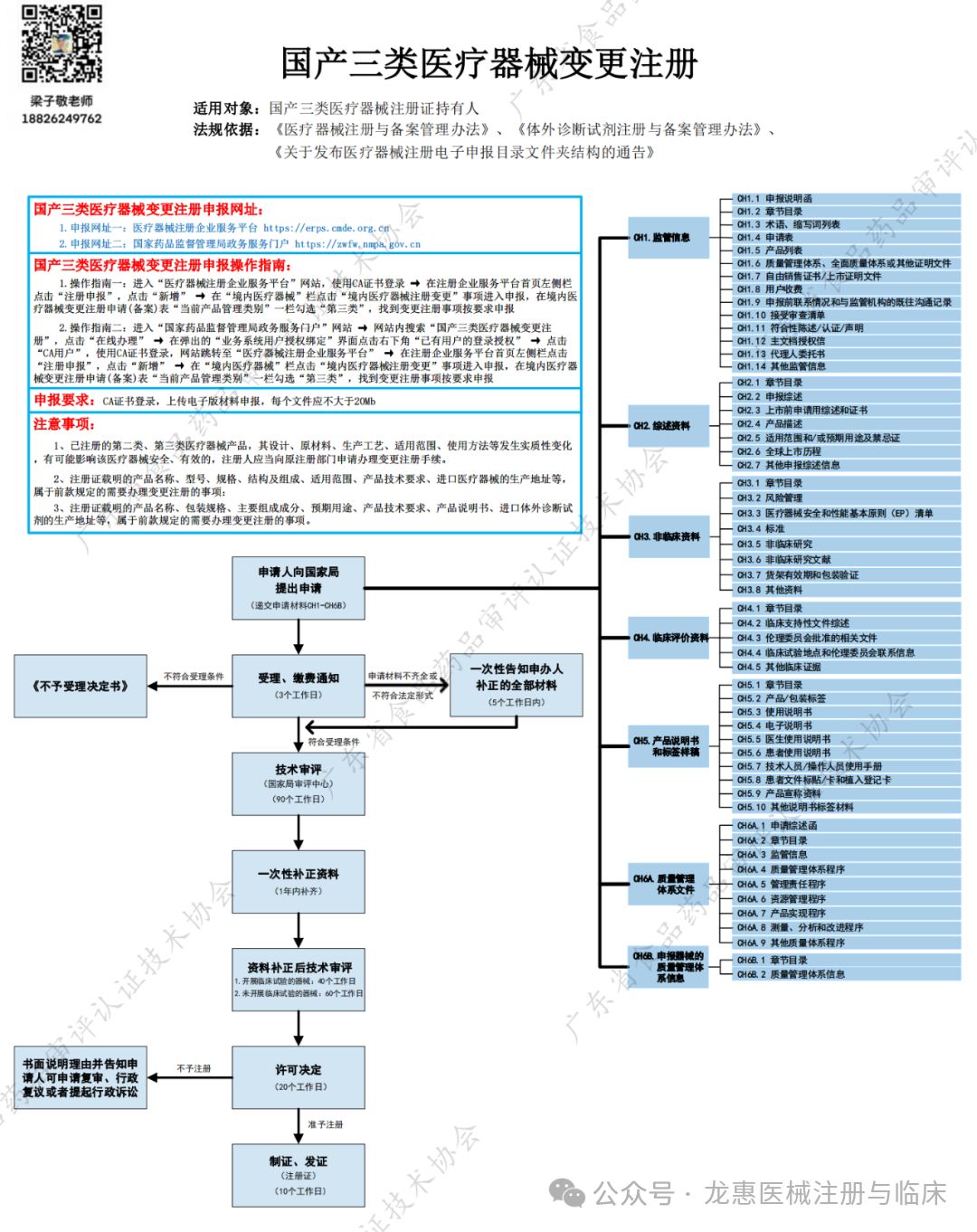
国产三类医疗器械变更注册
适用对象:国产三类医疗器械注册证持有人
法规依据:《医疗器械注册与备案管理办法》、《体外诊断试剂注册与备案管理办法》、《关于发布医疗器械注册电子申报目录文件夹结构的通告》
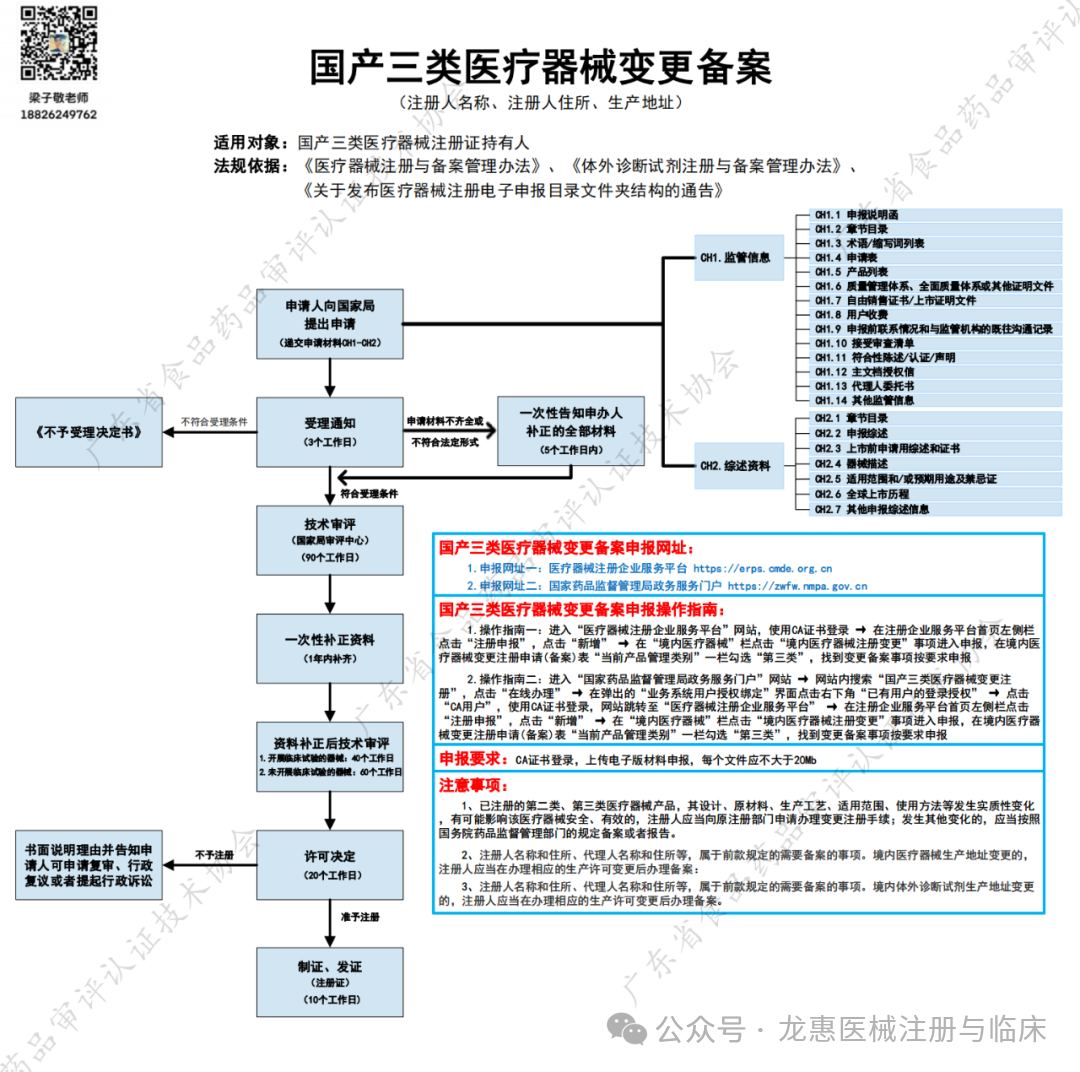
国产三类医疗器械变更备案(注册人名称、注册人住所、生产地址)
适用对象:国产三类医疗器械注册证持有人
法规依据:《医疗器械注册与备案管理办法》、《体外䈀断试剂注册与备案管理办法》、《关于发布医疗器械注册电子申报目录文件夹结构的通告》
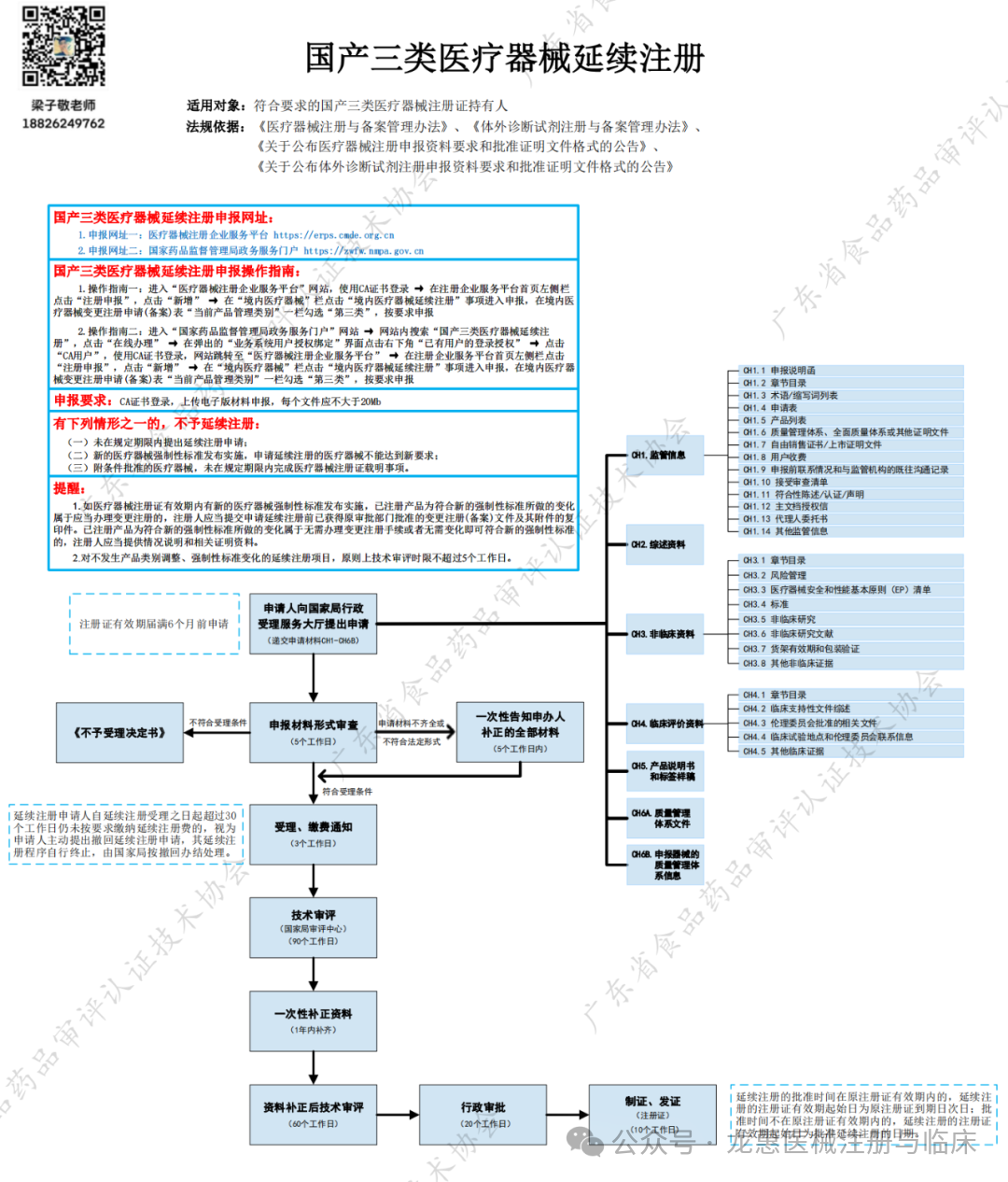
国产三类医疗器械延续注册
适用对象:符合要求的国产三类医疗器械注册证持有人
法规依据:《医疗器械注册与备案管理办法》、《体外诊断试剂注册与备案管理办法》、《关于公布医疗器械注册申报资料要求和批准证明文件格式的公告》、《关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告》