

留置针作为传统钢针的替代产品,代表着静脉输液的发展方向,已成为临床护理中不可或缺的重要耗材。
一、留置针产品分析
(一)产品定义与分类
留置针(静脉留置针)是由不锈钢的穿刺引导针芯、软的外套管及塑料针座构成的一种输液工具,作为头皮针的换代产品广泛应用于临床。使用时将导管和针芯一起穿刺入血管内,当导管全部进入血管后,回撤出针芯,仅将柔软的导管留置在血管内进行输液治疗。
产品分类:
按结构分类:开放式留置针(普通型和安全型)和密闭式留置针(普通型和安全型)
按功能分类:普通留置针、防针刺伤型留置针、避光留置针、透析用留置针等
(二)产品结构与组成
留置针通常由以下组件构成:
护套:保护针头
导管组合件:包括导管、楔型物和导管座
针头组合件:包括针管和针座
透气塞:保持透气性
可选组件:防针刺装置、延长管、无针连接件等
(三)产品优势与临床价值
留置针相比传统钢针具有显著优势:
减轻患者痛苦:避免反复穿刺,减少患者痛苦
提高护理效率:操作简单,减轻护理工作量
保证合理用药:便于输液,确保用药安全
降低感染风险:减少穿刺次数,降低感染风险
二、医疗器械注册证办理流程
(一)产品分类与管理类别
根据《医疗器械分类目录》,留置针属于:
分类编码:14-02-07
管理类别:第三类医疗器械
产品类别:血管内留置针
(二)注册证办理总体流程
留置针作为第三类医疗器械,注册证办理流程包括以下主要步骤:
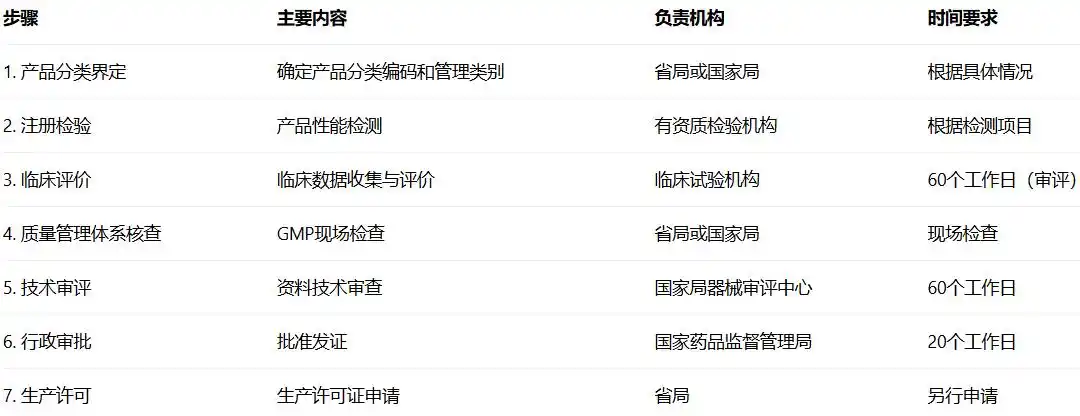
(三)详细办理步骤
1. 产品分类与注册单元划分
分类依据:
根据《医疗器械分类目录》确定分类编码为14-02-07
管理类别为第三类
产品名称为"一次性使用静脉留置针"
注册单元划分原则:
产品的主要组件导管、延长管的原材料(包括增塑剂)不同需划分为不同注册单元
宣称避光的留置针和非避光的留置针需划分为不同注册单元
2. 注册检验
检验要求:
按照产品技术要求进行全项目检验
检验报告可以是申请人自检报告或委托有资质检验机构出具
检验样品需具有代表性,能够代表注册单元内其他产品
主要检验项目:
物理性能:导管强度、柔韧性、耐压性等
化学性能:材料溶出物、重金属含量等
生物相容性:细胞毒性、致敏性、刺激反应等
灭菌验证:无菌保证水平达到1×10⁻⁶
3. 临床评价
临床评价路径:
留置针属于《免于进行临床评价医疗器械目录》产品,可以免于提交临床评价资料,但需提供以下资料:
免临床评价资料要求:
申报产品相关信息与《目录》所述内容的对比资料
申报产品与已获准境内注册的《目录》中医疗器械的对比说明
若存在差异,需提交差异部分对安全有效性影响的分析研究资料
对比内容:
产品名称、分类编码、管理类别
产品描述、预期用途、适用范围
结构组成、原材料、工作原理
性能指标、灭菌方式、货架有效期
4. 质量管理体系核查
体系要求:
建立符合《医疗器械生产质量管理规范》的质量管理体系
体系文件包括质量手册、程序文件、作业指导书、质量记录
体系需覆盖产品全生命周期管理
现场核查重点:
设计开发过程控制
采购与供应商管理
生产过程控制
检验与试验控制
不合格品控制
产品放行控制
5. 注册申报资料准备
主要资料清单:
(1)监管信息
申请表、产品列表
既往沟通记录、主文档授权信
企业资质证明文件
(2)综述资料
产品描述:结构组成、工作原理、预期用途
型号规格划分说明
研发历程
与同类产品对比分析
适用范围和禁忌证
(3)非临床资料
风险管理资料(参照GB/T 42062)
医疗器械安全和性能基本原则清单
产品技术要求
产品检验报告
研究资料(物理化学性能、生物相容性、灭菌研究等)
稳定性研究和包装研究
(4)临床评价资料
临床评价报告(免临床需提供对比资料)
临床试验方案和报告(如需临床试验)
(5)产品说明书和标签样稿
产品说明书
最小销售单元标签
使用说明、警示信息
(6)质量管理体系文件
质量手册
程序文件
作业指导文件
质量记录
6. 资料提交与技术审评
提交方式:
通过国家药品监督管理局网上系统提交
提交纸质资料至相应药品监督管理部门
技术审评:
审评时限:60个工作日
审评内容:安全性、有效性、质量可控性
审评过程中可能要求补充资料(发补)
7. 行政审批与发证
审批流程:
技术审评通过后,进入行政审批阶段
审批时限:20个工作日
审批通过后颁发医疗器械注册证
注册证有效期:
医疗器械注册证有效期为5年
需在有效期届满6个月前申请延续注册
8. 生产许可申请
申请要求:
取得注册证后申请生产许可证
需提交生产质量管理体系文件
接受生产许可现场核查
三、关键注意事项
(一)风险管理要求
留置针的风险管理需重点关注以下方面:
原材料风险:
生物不相容性
增塑剂、避光剂、着色剂等添加剂溶出
材料降解产物
生产过程风险:
微粒污染
热原反应
漏液、功能失效
标识不清
灭菌过程风险:
灭菌方式不适宜
灭菌不彻底
灭菌残留物(如环氧乙烷)
使用风险:
无针连接件未正确消毒
防针刺装置未正确启动
导管堵塞、脱落
(二)特殊性能要求
防针刺性能:
需参照《输注产品针刺伤防护装置要求与评价技术审查指导原则》
符合GB/T 42063《锐器伤害保护要求与试验方法》
避光性能:
需提供避光性能研究资料
可参考YY 0286.3《专用输液器第3部分:一次性使用避光输液器》
无针连接件:
需进行微生物侵入试验
参考YY/T 0923《液路、血路无针接口微生物侵入试验方法》
(三)持续合规要求
注册后管理:
定期进行质量体系自查
及时报告不良事件
产品变更需进行变更注册
注册证到期前申请延续注册
结语
留置针作为重要的静脉输液耗材,在临床应用中发挥着不可替代的作用。随着技术进步和市场需求的增长,留置针产品不断创新升级,从材料、结构到功能都实现了显著提升。在医疗器械注册证办理过程中,企业需严格按照法规要求,从产品分类、注册检验、临床评价到质量管理体系建立,全面确保产品的安全性、有效性和质量可控性。通过科学规范的注册申报流程,企业可以顺利获得医疗器械注册证,将高质量的留置针产品推向市场,为临床护理提供更好的解决方案,同时实现企业的可持续发展。
